一、简介
干细胞是一类结构和功能未充分分化、具有再生各种组织器官的潜在功能的原始细胞,存在于所有多细胞组织里。按干细胞的分化潜能,可将其分为专能干细胞(Unipotent stem cell)、多能干细胞(Pluripotential stem cell)和全能干细胞(Totipotent stem cell)。其中,以间充质干细胞为首的多能干细胞因其具有多向分化潜能的特点成为了当今临床研究的热门领域。
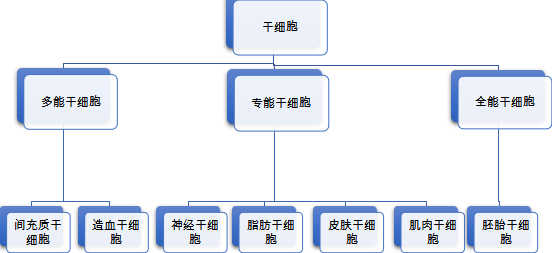
图1干细胞按分化潜能分类
间充质干细胞(MesenchymalStem Cells)具有自我更新和多向分化能力,来源于发育早期的中胚层和外胚层,主要存在于结缔组织和器官间质中。在成人组织中,间充质干细胞存在于骨髓、脂肪组织、外周血、牙髓和真皮中;在新生儿组织里还存在于脐带血、胎盘、羊水和脐带华通氏胶(Wharton’s jelly)中。和其它干细胞相比,间充质干细胞来源广泛,可取自于脐带、牙髓、脂肪和骨髓等组织,更易体外培养、长期传代稳定性更高,且具有更低的免疫原性和更强的组织修复能力。
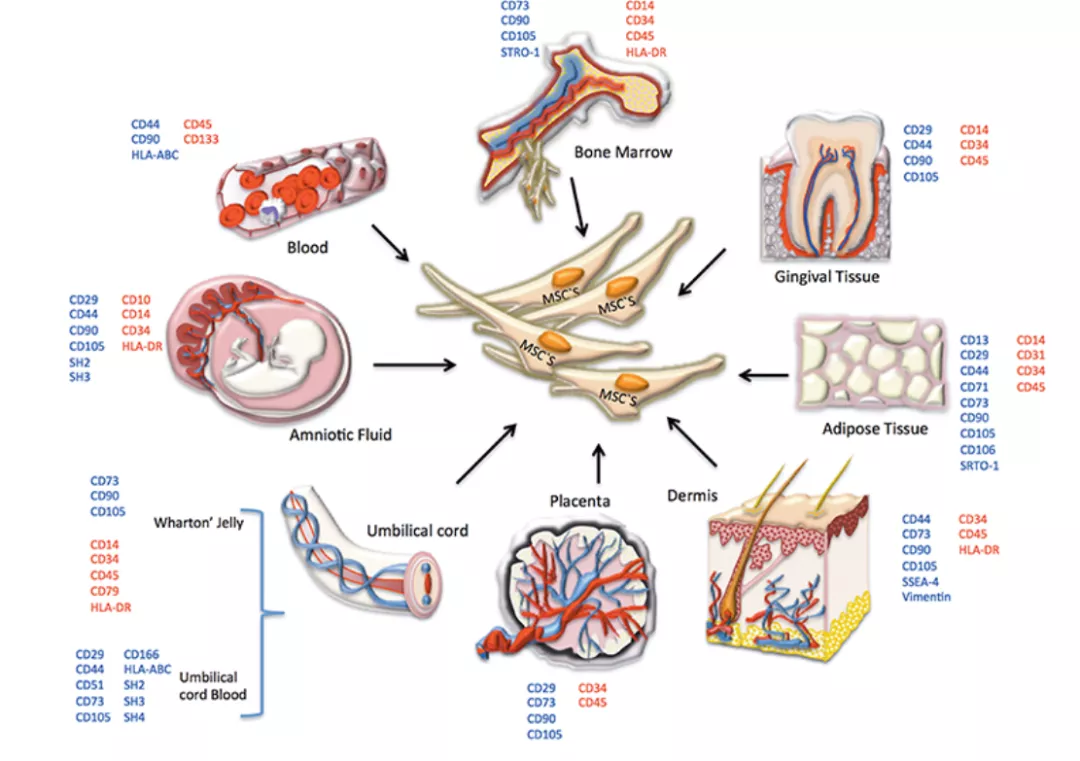
图2间充质干细胞的不同来源
二、作用机制与功能
间充质干细胞通过分泌PGE2、PDL1等免疫抑制分子,释放细胞因子、生长因子,以及刺激低氧诱导因子(HIF)、VEGF和HGF等促血管新生因子的表达,通过调节局部和全身的炎症和免疫反应来达到修复组织、免疫调节和促血管新生的生物功能,降低了压力和受损细胞凋亡的反应。其治疗机制较为复杂,多向分化、归巢、旁分泌等机制交叉作用,实现组织修复和再生、免疫调节、抗炎、抗凋亡、促进血管生成等功能。
(1)归巢效应。间充质干细胞归巢是指干细胞在目标组织的脉管系统里被捕获,随后跨越血管内皮细胞迁移至目标组织的过程。微环境改变是间充质干细胞归巢的始动因素,组织损伤局部表达多种趋化因子、黏附因子、生长因子等各种信号分子,特定信号分子再与间充质干细胞膜上相应受体结合,驱动其归巢行为。大量研究发现,当机体缺血、缺氧、损伤时,机体内或者外源性间充质干细胞具有向损伤部位优势分布的特质。归巢是间充质干细胞安全有效地应用于临床的关键。
(2)旁分泌。间充质干细胞的旁分泌效应,能够表达、合成、分泌各类生长因子、细胞因子、调节因子、信号肽等多种生物活性分子,调节代谢、免疫、细胞分化、增殖、迁移、凋亡等活性因子,并通过这些因子平衡机体的内稳态,为干细胞免疫调节、抗凋亡等提供了适宜的环境。如VEGF(vascular endothelial growth factor,血管内皮生长因子)、FGF(fibroblast growth factor,成纤维细胞生长因子)、Ang1/2(angiopoietin-1/2,促血管生成素1/2)、HGF(hepatocyte growth factor, 肝细胞生长因子)、PGF(placental growth factor,胎盘生长因子)、PDGF(platelet derived growth factor,血小板生长因子)和TGF-b(transforming growth factor-b,转化生长因子)等参与血管生成,促进血管内皮和平滑肌细胞的增殖和迁移,并促进缺血性血流恢复和血管重塑。
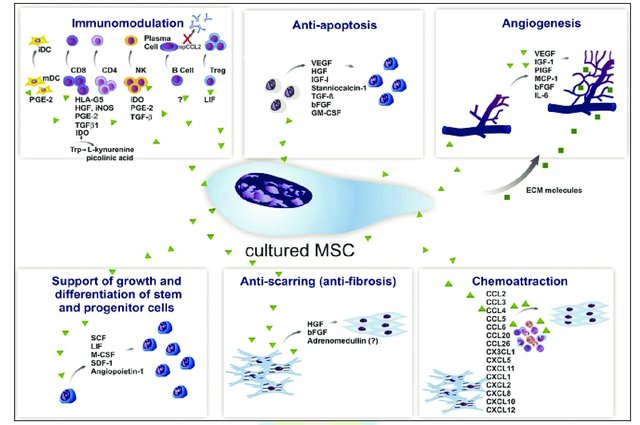
图3间充质干细胞的旁分泌作用
(3)抗炎作用。间充质干细胞具有低免疫原性和免疫调节特性, 在炎症环境中能抑制免疫系统, 发挥抗炎作用。目前的研究表明间充质干细胞的免疫调节作用主要是通过细胞间的接触和分泌细胞因子两种途径,通过固有免疫细胞和适应性免疫细胞发挥调节作用。MSCs可影响固有免疫细胞(包括树突状细胞、自然杀伤细胞,巨噬细胞、γδ T细胞等)的增殖、凋亡、免疫功能和迁移能力进行免疫调节。也可通过调节T细胞、B细胞进行适应性免疫调节。具体机制表现为抑制T淋巴细胞的增殖和活化,通过抑制细胞分裂使T淋巴细胞阻滞于GO/Gl期;抑制B淋巴细胞的增殖和分化,降低其表面趋化因子受体CXCR4、CXCR5、和CXCR7及其相应配体CXCL12、CXCL13的表达,使IgM、IgG和IgA的生成减少。
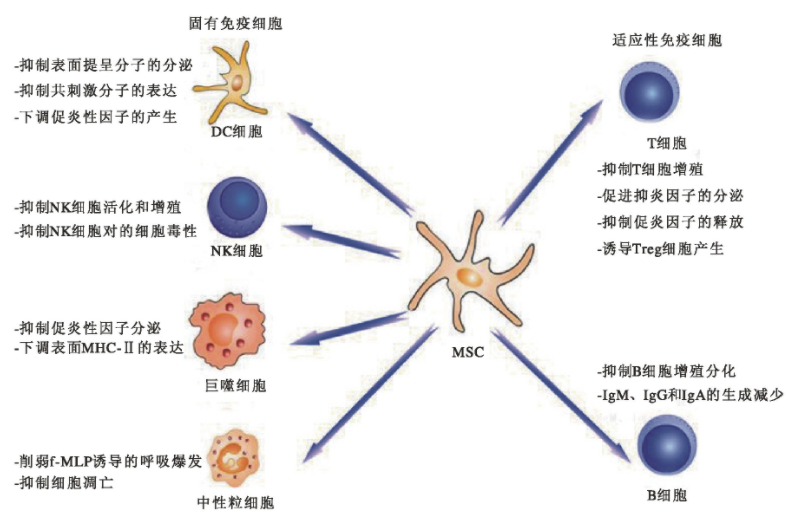
图4间充质干细胞的免疫调节机制
三、已上市药物和国内在研药物
间充质干细胞可用于修复受伤或病变的多种组织器官,已经证明其在免疫性疾病、缺血性疾病及各种组织损伤等多种疾病治疗中具有很好的疗效。单独使用可改善细胞或器官移植后免疫排斥反应,提高移植成功率。
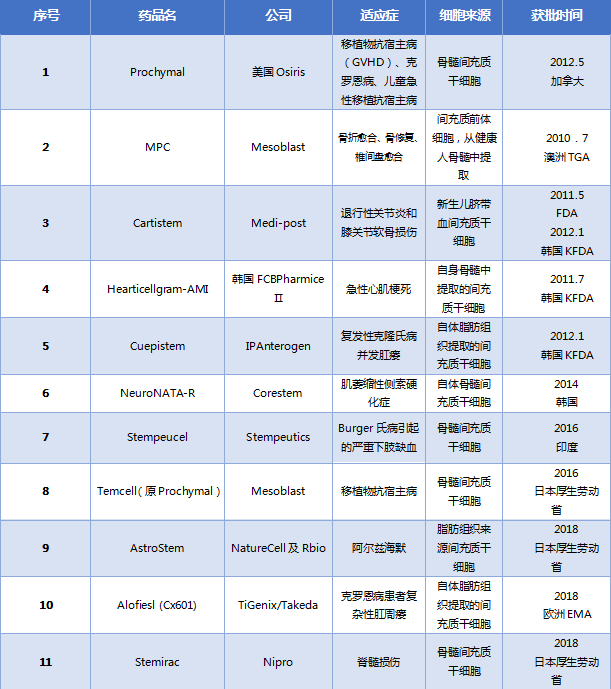
自1995年第一例间充质干细胞临床应用起——由恶性血液患者骨髓分离培养出贴壁的基质细胞再输注回患者体内,间充质干细胞的临床效果和安全性得到了验证。骨髓来源的间充质干细胞是最早应用于临床试验的一类间充质干细胞。近年来,自体脂肪及新生儿脐带等组织来源的间充质干细胞亦被广泛应用到临床试验。截至2021年11月,全球共有11种间充质干细胞药物上市(表1),其适应症选择主要是根据其免疫调控和促进血管生成这两个生物学特性。
表1 全球已上市的主要MSC药物
四、我国间充质干细胞在研项目
截至2020年3月,在 ClinicalTrial.gov 上注册的干细胞相关临床研究已达5432项,其中中国有469项。我国间充质干细胞药物研发尚处于早期阶段,还未有上市药品。截至2021年11月,获得CDE临床试验批准的间充质干细胞项目共有18项,CDE登记开展的临床试验共有12项(表2),其中进展最快的处于临床II期阶段。
表2 我国间充质干细胞获批在研项目情况
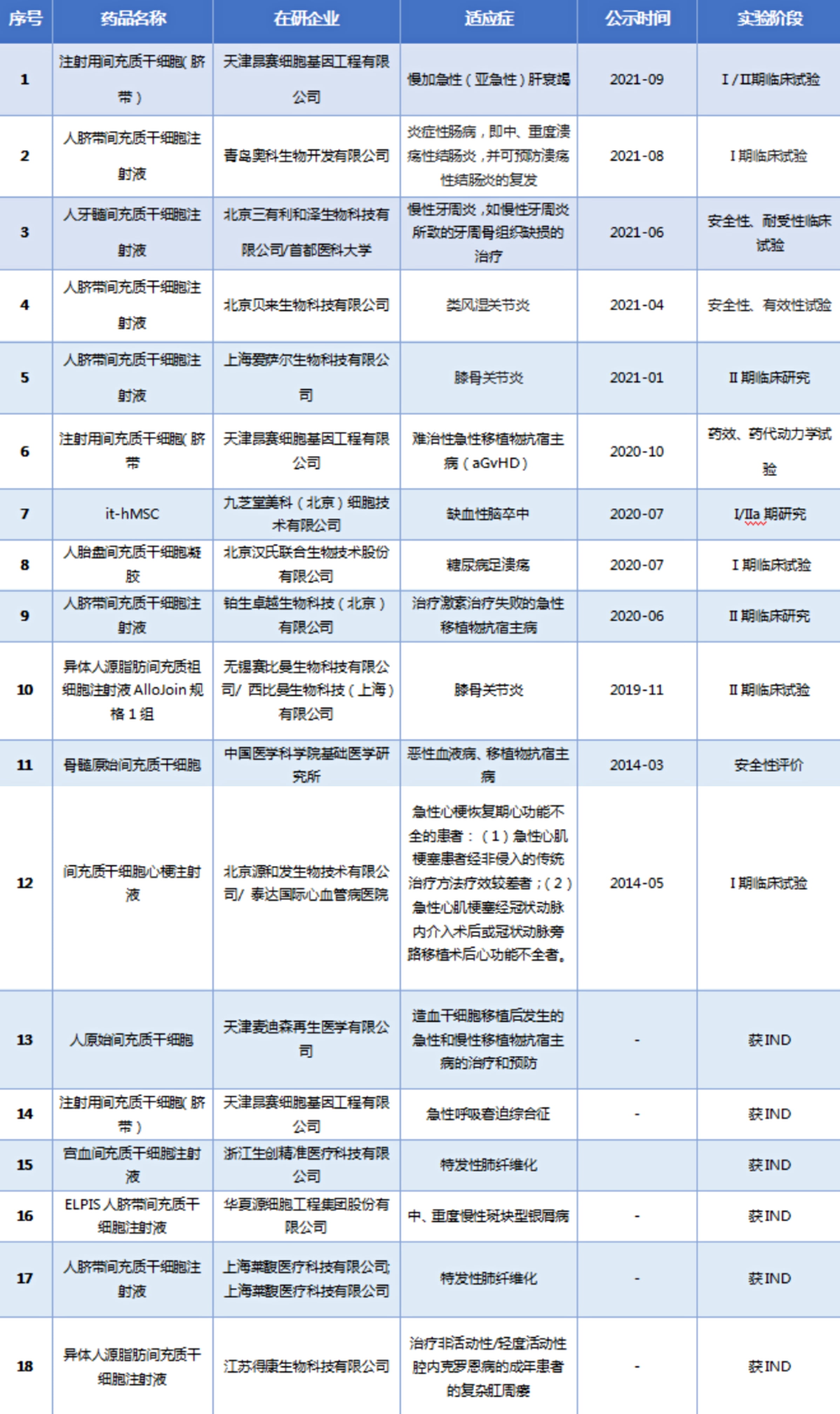
在研项目中以骨关节炎进展最快。骨关节炎是一种退行性关节病,由关节软骨受损引起。干细胞治疗是最有前景的有效关节软骨再生方法。西比曼生物于今年9月完成私有化后的1.2亿美元A轮融资,将加速已进入Ⅱ期临床后期的AlloJoin®异体脂肪间充质干细胞治疗膝骨关节炎的临床及商业化进程。根据其于2018年3月公布的I 期临床试验 48 周临床数据显示,AlloJoin具有良好的安全耐受性和预防软骨恶化的早期疗效迹象。同样是治疗膝骨关节炎,上海爱萨尔生物科技有限公司的人脐带间充质干细胞注射液IxCell hUC-MSC-O目前正在进行临床Ⅱ期试验,目前已入组15例患者。
五、技术进展
以干细胞治疗为代表的“再生医学”技术引领着继药物治疗、手术治疗之后的新一轮医学革命,作为前沿的医疗技术,为一些难治性疾病带来了希望。如2021年10月18日,一名严重的1型糖尿病患者在接受Vertex制药公司干细胞来源的完全分化的胰岛细胞替代疗法后,胰岛细胞功能显著恢复,可以让患者调节胰岛素甚至自己产生胰岛素。这一例患者的成功案例为开发取代胰岛素注射治疗的细胞疗法奠定了基础。除了糖尿病的应用领域,全球干细胞治疗的热门市场还有地中海贫血、脑瘫、白血病、自闭症等。
与CAR-T、CAR-NK细胞疗法的结合也是间充质干细胞技术未来临床应用的一大热门。除了从组织中分离原代的间充质干细胞之外,利用细胞工程从诱导性多能干细胞iPSC(InducedPluripotent Stem Cells)中获得组织细胞成为了间充质干细胞来源的重要策略,可以解决获得细胞数量和扩增代数受限的问题。2018年,澳大利亚公司Cynata Therapeutics基于iPSC分化的间充质细胞疗法iMSC-CYP-001成为全球首个同种异体iPSC衍生的细胞产品。其针对移植物抗宿主病的I 期临床试验已于2018年8月完成,公司将继续探索iPSC衍生的间充质干细胞在多种炎症和免疫介导疾病中的治疗应用。2019年2月,美国Fate Therapeutics公司的iNK细胞疗法FT516成为全球首个获得FDA批准进行临床试验的iPSC衍生细胞疗法,于2020年3月开始用于治疗复发/难治性B细胞淋巴瘤和慢性淋巴细胞白血病的I期临床试验。
此外,干细胞在修复受损的成年脑神经环路、促进急性肠型放射病救治、治疗阿尔茨海默病、改善炎症性肠病等领域也有技术性进展。干细胞技术的研究突破也为临床治疗的研究提供了更多思路。
2021年2月,Science发表的一项研究成果显示,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组首次开发了能够长时程示踪体内细胞增殖的新技术,利用该技术研究人员发现了成体肝细胞的来源,展现了所有肝细胞类群的增殖情况,首次发现肝小叶中间区域(Zone 2)的肝细胞是成体肝脏在生理稳态中新生肝细胞的主要细胞来源,同时揭示了不同损伤再生模型中新生肝细胞的来源,为肝脏再生及疾病临床治疗研究提供了新思路。
2021年3月,来自Nature的两篇背靠背论文,从培养皿中的人类囊胚的人类胚胎干细胞和人类皮肤成纤维细胞(HDFs)成功构建了人类胚泡样结构,是人类胚胎的第一个完整模型,为推进人类胚胎学提供了有价值的模型。
间充质干细胞在临床应用方面展现了强大的潜力,但同时需要对间充质干细胞治疗中更多的细节进行研究,就准备间充质干细胞的流程、给药方式、给药剂量等等进行优化,寻求更加规范的移植方法,为患者提供更加高效的治疗方案。
参考文献
Bloor, A., Patel, A., Griffin, J. E., Gilleece, M. H., Radia, R., Yeung, D. T., Drier, D., Larson, L. S., Uenishi, G. I., Hei, D., Kelly, K., Slukvin, I., & Rasko, J. (2020). Production, safety and efficacy of iPSC-derived mesenchymal stromal cells in acute steroid-resistant graft versus host disease: a phase I, multicenter, open-label, dose-escalation study.Nature medicine,26(11), 1720–1725.
Clarisse, G(2018). Therapeutic potential of mesenchymal stem cells in dystrophic recessive epidermolysis bullosa. Génétique humaine. Université Sorbonne Paris Cité. Français.
Darmayanti, S., Triana, R., Chouw, A. and Dewi, N.M., 2017. Is stem cell a curer or an obstruction?.Molecular and Cellular Biomedical Sciences,1(1), pp.17-27
He, L., Pu, W., Liu, X., Zhang, Z., Han, M., Li, Y., Huang, X., Han, X., Li, Y., Liu, K. and Shi, M., 2021.Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair.Science,371(6532).
Kabat, M.,Bobkov, I., Kumar, S.,Grumet, M (2019).Trends in mesenchymal stem cell clinical trials 2004‐2018: Is efficacy optimal in a narrow dose range?STEM CELLS Transl Med.1–11.
Liu, X., Tan, J.P., Schröder, J.et al.Modelling human blastocysts by reprogramming fibroblasts into iBlastoids.Nature591,627–632 (2021).
Martinez, A. M., Goulart, C. O., Ramalho, B., Oliveira, J. T., & Almeida, F. M. (2014). Neurotrauma and mesenchymal stem cells treatment: From experimental studies to clinical trials.World journal of stem cells,6(2), 179–194.
Mesenchymal Stem Cells (MSCs). 2021. CELLPEDIA. Available from:https://cellpedia.org/en/mesenchymal-stem-cells/ (Accessed 2021.10)
Yu, L., Wei, Y., Duan, J.et al.Blastocyst-like structures generated from human pluripotent stem cells.Nature591,620–626 (2021).
吕云.,王立生(2019). 诱导多能干细胞来源的间充质干细胞的生物学特性[J]中国实验血液学杂志. 2019,27(04). 1253-1258.
医药魔方(2021).2021H1全球细胞疗法投资报告.Ava:https://mp.weixin.qq.com/s/ICG_C1qVF1fPEsk8-11kPA
间充质干细胞产品的几个开发方向(2021).干细胞者说. Ava: https://mp.weixin.qq.com/s/sutaWmAPAwJGsx7EpYh8tw
薛鑫淼,蒋军,陈学敏,徐瑾,邓森林,李鑫,王小成.间充质干细胞在抗炎治疗中的应用进展[J].解放军医学院学报,2018,39(11):1008-1012.
